PIGMENTOS DAS SEMENTES DE URUCUM
A bixina, considerada o principal pigmento presente nas sementes de urucum, pertence a uma classe de pigmentos naturais denominados carotenóides. Os carotenóides foram reconhecidos como compostos químicos por volta de 1831 com a separação dos pigmentos da cenoura por WACKENRODER. A esses pigmentos o autor deu o nome de “carotin”, por sua relação com esse vegetal (carrot em inglês) (DEUEL, 1951). Atualmente são conhecidas mais de 600 estruturas diferentes de carotenóides que estão amplamente distribuídas no reino vegetal e animal.
Os carotenóides podem ser divididos em dois grupos: os carotenos, cujas estruturas químicas são formadas apenas por carbonos e hidrogênios e as xantofilas, que apresentam também o oxigênio em suas moléculas, como a bixina e a norbixina. Esses dois carotenóides também pertencem à classe dos apocarotenoides, denominação dada em virtude das perdas de carbonos nas extremidades da estrutura molecular de C40. A pigmentação dos carotenóides se deve à série de duplas ligações conjugadas presentes em suas moléculas.
A bixina foi primeiramente isolada por BOUSSINGAULT em 1825. A elucidação da fórmula molecular da bixina como C25H30O4 foi apresentada por HEIDUSCHKA e PANZER em 1917 e em 1923 HERZIG e FALTIS descreveram a bixina como o éster monometílico de um ácido dicarboxílico insaturado. Contudo, a hipótese de assimetria molecular foi abandonada quando uma nova estrutura foi proposta por KUHN e WINTERSTEIN em 1932 e confirmada por KARRER et al. naquele mesmo ano. Como resultado dessas investigações concluiu-se que a bixina foi o primeiro cis-polieno de ocorrência natural conhecido (GIRIDHAR et al, 2014; SCOTTER, 2009).
A isomeria cis-trans ocorrem em moléculas isoméricas cujos ligantes mudam de posição no espaço, mas permanecem ligados aos mesmos átomos. Os isômeros cis apresentam os substituintes no mesmo lado da molécula enquanto os isômeros trans apresentam os substituintes em lados opostos. Esse tipo de isomeria é muito comum em moléculas de carbonos insaturados (com duplas ligações) como a bixina e a norbixina. A bixina foi o primeiro carotenóide a ser apresentado com isomerismo geométrico (GIRIDHAR et al, 2014). A maioria dos carotenóides é encontrada naturalmente na configuração trans por esta ser a configuração mais estável.

A isomerização dos carotenóides pode ocorrer sob determinadas condições de aquecimento, luz e acidez do meio. Essa transformação pode ser apresentada em uma ou mais duplas ligações formando uma mistura de isômeros cujas proporções dependem das condições que a molécula foi submetida. A quantidade de estereoisômeros de diferentes configurações possíveis de serem formados em um carotenóide está relacionado ao número de duplas ligações existentes e a ausência de impedimentos estéricos. A Bixina possui nove duplas ligações e teoricamente poderia ter 512 isômeros geométricos (29 = 512), enquanto a norbixina por causa de sua simetria (estrutura similar em ambos os lados da molécula) poderia ter 272 isômeros (2 [(9-1)/2]-1). Contudo, impedimentos estéricos nos carbonos 7, 11, 12’ e 8’ só possibilitam a presença de 32 isômeros para a bixina e 20 isômeros para a norbixina (SCOTTER, 2009). A figura a seguir apresenta os principais isômeros para a bixina e norbixina.
A isomeria geométrica pode alterar as propriedades de algumas moléculas. O isômero all-trans-bixina é mais estável e apresenta cor vermelha e solubilidade em óleo vegetal. O isômero 9’-cis-bixina é pouco solúvel em óleo vegetal e apresenta cor alaranjada.
A 9´-cis-norbixina é solúvel em soluções alcalinas nas quais apresenta uma cor alaranjada intensa (SCOTTER, 2009).
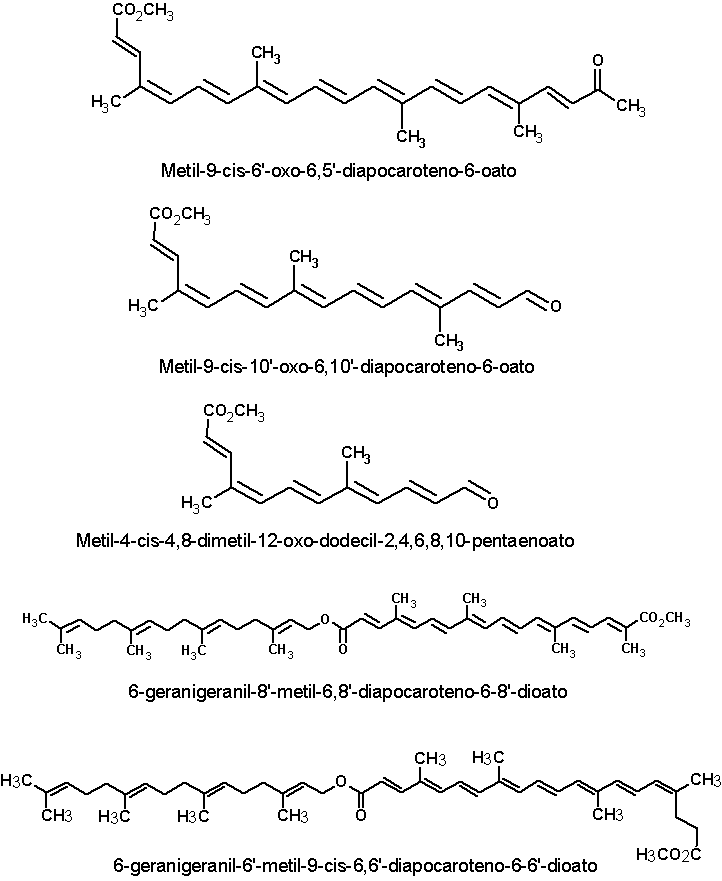
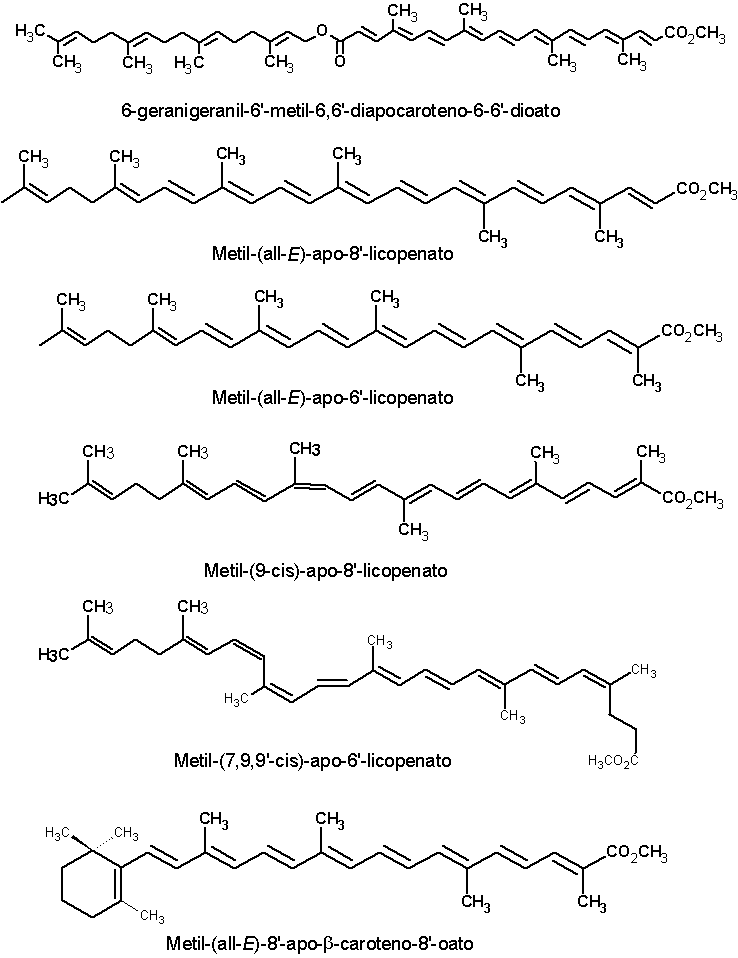
Além da bixina e da norbixina, as sementes de urucum contém vários outros carotenóides em pequenas concentrações, geralmente inferiores a 1% dos carotenóides totais. Dezesseis desses pigmentos estão apresentados a seguir: metil, 9’- cis-apo-6’-licopenato; dimetil 9’-cis-6,6’-diapocaroteno-6-6’-dioato (metil bixina); Dimetil-9-cis-9’-cis-6,6’-diapocaroteno-6,6’- dioato; metil 9-cis-8’-oxo-6,8’- diapocaroteno-6-oato; Metil-9-cis-6'-oxo-6,6'-diapocaroteno-6-oato; Metil-9-cis-6'-oxo-6,5'-diapocaroteno-6-oato; Metil-9-cis-10'-oxo-6,10'-diapocaroteno-6-oato; Metil-4-cis-4,8-dimetil-12-oxo-dodecil-2,4,6,8,10-pentaenoato; 6-geranigeranil-8'-metil-6,8'-diapocaroteno-6-8'-dioato; 6-geranigeranil-6'-metil-9-cis-6,6'-diapocaroteno-6-6'-dioato; 6-geranigeranil-6'-metil-6,6'-diapoca- roteno-6-6'-dioato; Metil-(all-E)-apo-8'-licopenato; Metil-(all-E)-apo-6'-licopenato; Metil-(9-cis)-apo-8'-licopenato; Metil-(7,9,9'-cis)-apo-6'-licopenato; Metil-(all-E)-8'-apo-b-caroteno-8'-oato (JONDIKO & PATTENDEN,1989; MERCADANTE et al.,1996; MERCADANTE et al., 1997a,b; MERCADANTE e PFANDER, 2001). As estruturas químicas dessas substâncias estão apresentadas a seguir. Clique sobre a estrutura para ver em maior resolução.